- 2011-2020년 10년간, 임상 개발 성공률과 기여 요인 분석
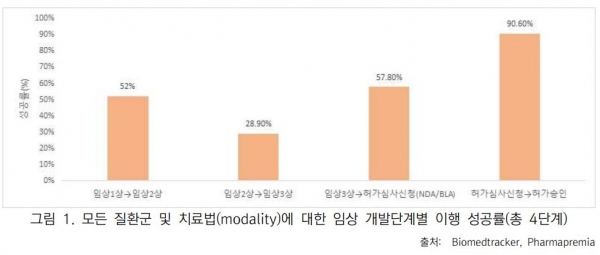
미국바이오협회의 분석자료 결과, 지난 10년간(2011-2020) 모든 의약품 후보물질에 대한 임상 1상에서 품목 허가 승인까지의 성공률(LOA, Likelihood of Approval)은 7.9%인 것으로 나타났다.
한국바이오협회의 자료에 따르면,
임상 2상은 신약 허가개발의 가장 큰 장애물이었으며, 임상 2상 후보 물질의 28.9%만이 임상 3상 진입했다.
14대 주요 질환군 중 혈액질환 치료물질은 임상 1상~승인까지 가장 높은 성공률(23.9%)을 보였으며, 가장 낮은 임상 성공률 수치를 보인 비뇨질환(3.6%)보다 7배가량 차이났다. 면역항암제 치료물질 임상성공률 12.4%, 반면 종양 전체 임상성공률은 5.3%에 불과했다.
종양은 질환군 중 가장 많은 임상 프로그램 이행이 이뤄짐에도 불구하고 임상 1상~승인 수치가 낮게 나타났다.

희귀병 치료물질은 임상 1상~승인 성공률이 17.0%로 두드러지게 성공적인 수치를 보였으며, 높은 유행성 만성 질환 치료 물질 전체 LOA는 5.9%로 성공률 낮았다. CAR-T와 RNAi 등과 같이 치료방법(모달리티)에 있어 생물학적 복잡성을 가진 의약품들이 일반적으로 높은 임상성공률을 보였다.(CAR-T 17.3%, RNAi 13.5%).
바이오마커를 통해 사전 선정된 환자를 대상으로 임상시험의 경우 임상 2상에서의 높은 성공률로 인해 전체 LOA 수치가 2배 가량 높게 나타났다(15.9%).
임상 1상에서 허가승인까지(LOA) 단계별 성공에 기여하는 가장 큰 요인은 적응증, 타겟, 모달리티, 약물의 신규성 등이었다.
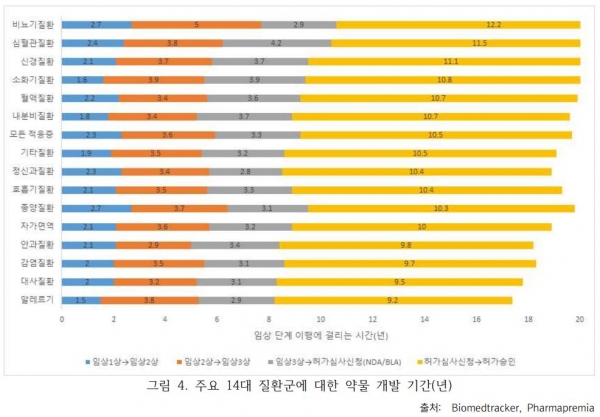
임상 1상에서 품목허가 승인까지 기간은 평균 10.5년 걸렸다. 평균의 LOA를 상회하는 질환군은 가장 짧은 개발기간을 거치는 경향이 있었다.

[시사점]
종양의 경우 의약품 시장에서 가장 큰 부문을 차지하나, 임상 1상-품목허가 승인까지의 성공률(LOA)에서는 가장 낮은 5.3%의 수치를 보였다.
종양은 LOA 수치를 증가시키는 주요 질병 중 하나로, 이전 2016년 보고서와 분석해 비교하면 이전의 5.1%에 비해서 소폭 증가했으며, 면역항암제 외에도 LOA 수치 향상 요인으로는 임상시험에 도움을 줄 수 있는 바이오마커 기반 환자모집단의 증가 및 새로운 약물(CAR-T, ADC 등) 모달리티의 성공 때문으로 보여졌다.
종양의 전체 성공률(5.3%)은 여전히 전체평균 7.9%에 비해 아래이며, 비종양질환 9.3%에 비해서도 떨어졌다. 희귀 종양의 경우 LOA가 6.8%로 많은 종양의 수치에 실질적인 이점을 확인할 수 없었다.
종양 프로그램이 의약품 산업의 임상 1상-LOA 수치를 낮추는 주된 요인이었다. 그럼에도 불구하고, 지난 10년간 전체 의약품 시장 벤처 자본 절반이 항암제 개발 회사에 투자되었다.
임상 2상의 개념 증명(입증)으로 전반적인 성공률 및 임상 이행 성공률을 향상시키는 것이 임상 연구 개발의 쟁점이다.
일반적으로 개념 증명없이 임상 3상 진입 연구를 하면, 임상 3상에서 NDA/BLA(허가 심사 신청) 이행 단계로의 성공률이 떨어졌다.
높은 유행성 질환, 만성 질환에서는 희귀질환 R&D 특성과 상이하여 별도의 연구가 필요하다.
산업 평균적으로 만성질환 및 유행성 질환이 훨씬 성공률이 높지만 희귀질환 R&D의 범위가 증가함에 따라 전반적인 성공률은 저하되었다.(이 보고서에 계산된 임상 1상-LOA 수치는 17.0%로, 2016년에 보고된 25.3% 수치보다 크게 감소)
임상 이행 프로그램 수가 증가함에 따라 생소한 생물학, 병리학 치료 양상을 연구하면서 희귀질환에 관한 연구 수도 증가하였지만 이는 근본 원인을 규명하는데 어려움이 따른다.
희귀 질환 R&D 영역은 규제 인센티브와 평균 이상의 임상 성공률을 토대로 상업적 잠재력을 기대하며 지속적인 투자가 이루어져야 한다.
[임상 시험 성공의 예측 분석 요인]
희귀질환과 같은 여러가지 요인이 많은 의약품산업 시장에서는 리스크와 비용을 줄이기 위해 임상시험 결과를 예측하는데 높은 정확성을 요구함. 정확한 예측분석은 약물 실패 감소, 승인 시간 단축 및 자본비용 절감 등 더 나은 치료법을 도출할 수 있게 한다.
예측 모델에서 개별 특징의 상대적 중요성은 시험 결과, 규제, 다른 적응증에 대한 사전 승인, 바이오마커 기반 환자 증가, 약물 모달리티 등 200개 이상의 특정 집합에서 성공을 예측하는 것으로, 정확도를 높이는데 중요하다.
[임상 프로그램의 시간 증가에 따른 리스크]
앞서 언급한 것처럼 2011-2020년 간 임상 1상에서 허가승인까지의 평균 소요시간은 10.5년이 걸렸다. 이 기간은 기업 및 투자자의 위험요소로 작용하며, 임상 개발의 어려움을 보여주고 있다.
특정 질병에서의 임상 소요시간과 파이프라인의 단계별 성공률과는 상관관계가 작용한다. 예를 들면, 비뇨기질환, 심혈관질환의 경우 가장 긴 임상프로그램 기간(12.2년, 11.5년)의 수치를 보였는데, 임상 1상에서 품목허가 승인까지의 성공률은 3.6%, 4.8%로 낮은 수치를 기록했다.
이러한 경우는 환자모집기간이 길고 복잡한 임상평가변수를 요하는 질환 같은 경우 적용될 수 있을 것이다. 예를 들어, 알츠하이머 임상 2상 시험 기간이 코로나19 항체 임상 2상 시험 기간보다 짧지 않은 것도 위와 같은 이유로 볼 수 있다.
항암제 개발기간의 경우 임상기간은 10.3년으로 전체 평균 10.5년과 비슷하나 다른 질환군과 다르게 임상 1상이 길고 품목허가 신청기간이 짧은 특징이 있다. 이를 해결하기 위해 종양 치료제 개발자들은 대체적으로 임상 1상 단계에서 바구니형 임상시험(Basket trial) 디자인을 채택하며 이를 통해 코호트를 확대하기 전에 하나의 임상시험에서 여러 다른 적응증을 연구하는 방법으로 진행하고 있다.
* 자료제공 : 한국바이오협회






